76. Растворимость.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Поэтому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворенного вещества к массе насыщенного раствора или количеством растворенного вещества, содержащимся в насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости.
насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г. воды растворяется более 10 г. вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г. вещества — малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г. вещества.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества — в неполярных растворителях (бензол, сероуглерод).
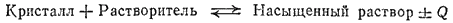
Рис. 75. Зависимость растворимости некоторых солей в воде от температуры.
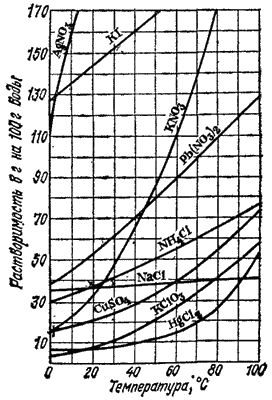
Рис. 76. Зависимость растворимости сульфата натрия в воде от температуры.
Растворение большинства твердых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором
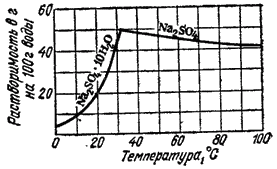
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации (сольватации) достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде щелочей, многих солей лития, магния, алюминия.
Зависимость между растворимостью и температурой очень удобно изображать графически — в виде кривых растворимости. Для построения кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной — растворимость вещества при соответствующей температуре.
На рис. 75 приведено несколько характерных кривых растворимости. Резко поднимающиеся вверх кривые растворимости нитратов калия, свинца, серебра показывают, что с повышением температуры растворимость этих веществ сильно возрастает. Растворимость хлорида натрия лишь незначительно изменяется по мере повышения температуры, что показывает почти горизонтальная кривая растворимости этой соли. Более сложный вид имеет кривая растворимости сульфата натрия (рис. 76).
До
 эта кривая круто поднимается, что указывает на быстрое увеличение растворимости. При
эта кривая круто поднимается, что указывает на быстрое увеличение растворимости. При
 происходит резкий излом кривой, после чего она идет несколько вниз. Следовательно, сульфат натрия обладает наибольшей растворимостью при
происходит резкий излом кривой, после чего она идет несколько вниз. Следовательно, сульфат натрия обладает наибольшей растворимостью при
 . Наличие максимума на кривой растворимости сульфата натрия объясняется тем, что ниже
. Наличие максимума на кривой растворимости сульфата натрия объясняется тем, что ниже
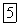 в равновесии с насыщенным раствором находится кристаллогидрат
в равновесии с насыщенным раствором находится кристаллогидрат
 , растворение которого сопровождается поглощением теплоты; но при более высоких температурах твердая фаза, находящаяся в равновесии с насыщенным раствором, представляет собой безводную соль
, растворение которого сопровождается поглощением теплоты; но при более высоких температурах твердая фаза, находящаяся в равновесии с насыщенным раствором, представляет собой безводную соль
 , растворяющуюся с выделением теплоты.
, растворяющуюся с выделением теплоты.
При растворении твердых тел в воде объем системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т. е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие — взаимно растворяются лишь до известного предела. Так, если взболтать диэтиловый эфир с водой, то образуются два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний — насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже
 фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Температура
фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Температура
 — критическая температура растворения для системы вода — фенол: начиная с этой температуры, обе жидкости неограниченно растворимы друг в друге.
— критическая температура растворения для системы вода — фенол: начиная с этой температуры, обе жидкости неограниченно растворимы друг в друге.
Как и в случае растворения твердых тел, взаимное растворение жидкостей обычно не сопровождается значительным изменением объема. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч атмосфер).
Если в систему, состоящую из двух иесмешнвающихся жидкостей, ввести третье вещество, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет распределяться между обеими жидкостями пропорционально своей растворимости в каждой из них. Отсюда вытекает закон распределения, согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
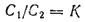
Здесь
 и
и
 — концентрации растворенного вещества в первом и втором растворителях; К — так называемый коэффициент распределения.
— концентрации растворенного вещества в первом и втором растворителях; К — так называемый коэффициент распределения.
Так, коэффициент распределения пода между водой и хлороформом равен 130. Если к воде, содержащей растворенный
 , добавить не смешивающийся с нею хлороформ, взболтать эту систему и дать ей отстояться, то после установления равновесия концентрация иода в хлороформе окажется в 130 раз более высокой, чем в воде, независимо от общего количества растворенного иода. Таким образом с помощью хлороформа можно извлечь (экстрагировать) из воды преобладающую часть растворенного в ней иода. Такой, основанный на законе распределения способ извлечения растворенного вещества из раствора с помощью второго растворителя, не смешивающегося с первым, называется экстракцией и широко применяется в лабораторной практике и в химической промышленности.
, добавить не смешивающийся с нею хлороформ, взболтать эту систему и дать ей отстояться, то после установления равновесия концентрация иода в хлороформе окажется в 130 раз более высокой, чем в воде, независимо от общего количества растворенного иода. Таким образом с помощью хлороформа можно извлечь (экстрагировать) из воды преобладающую часть растворенного в ней иода. Такой, основанный на законе распределения способ извлечения растворенного вещества из раствора с помощью второго растворителя, не смешивающегося с первым, называется экстракцией и широко применяется в лабораторной практике и в химической промышленности.
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух.
Однако растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры растворимость газа увеличивается.
При растворении газа в жидкости устанавливается равновесие:
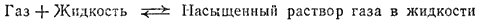
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа.
К этому же выводу можно прийти, исходя из динамического характера равновесия между газом и его раствором в жидкости. Молекулы газа, находящиеся над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газа. Перешедшие в раствор молекулы в свою очередь время от времени ударяются о поверхность жидкости изнутри и вылетают наружу. По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения, т. е. число молекул, уходящих из раствора в единицу времени, тоже будет расти, пока, наконец, не сравняется со скоростью растворения.
В результате установится состояние равновесия, т. е. жидкость станет насыщенной газом.
Если теперь увеличить давление газа, например, в 2 раза, то во столько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул, очевидно, тоже должна увеличиться вдвое.
Таким образом, приходим к выводу, который известен под названием закона Генри:
Масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа.
Закон Генри может быть выражен уравнением
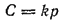
где С — массовая концентрация газа в насыщенном растворе;
 — парциальное давление; k — коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри).
— парциальное давление; k — коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри).
Отметим важное следствие закона Генри. Пусть при данном давлении в некотором объеме жидкости растворяется один объем газа, содержащий m г этого газа. Не меняя температуры, увеличим давление в n раз. При этом, согласно закону Бойля — Мариотта, объем, занимаемый газом, уменьшится в n раз; следовательно, масса газа, содержащегося в единице объема, возрастет в n раз и составит
 г. С другой стороны, в соответствии с законом Генри масса газа, растворяющегося в определенном объеме жидкости, также возрастет в n раз, т. е. также станет равна
г. С другой стороны, в соответствии с законом Генри масса газа, растворяющегося в определенном объеме жидкости, также возрастет в n раз, т. е. также станет равна
 г. Иначе говоря, в данном объеме жидкости по-прежнему будет растворяться один объем газа.
г. Иначе говоря, в данном объеме жидкости по-прежнему будет растворяться один объем газа.
Следовательно, объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления. Именно поэтому растворимость газов обычно выражают не в граммах, а в миллилитрах, указывая объем газа, растворяющийся в
 растворителя.
растворителя.
Растворимость некоторых газов в воде при 0 и при
 приведена в табл. 10.
приведена в табл. 10.
Если над жидкостью находится смесь нескольких газов, то растворимость каждого из них определяется его парциальным давлением. Это необходимо учитывать при расчете растворимости газов, находящихся в смеси с другими газами.
Газы подчиняются закону Генри при не очень высоких давлениях и притом лишь в случае, когда они не вступают в химическое взаимодействие с растворителем.
Таблица 10. Растворимость газов в воде

При высоких давлениях, когда поведение всех газов заметно отличается от идеального, отклонение от закона Генри наблюдается и в случае газов, химически не взаимодействующих с растворителем.
| << Предыдущий параграф | Следующий параграф >> |
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
