140. Оксиды азота.
Азот образует с кислородом ряд оксидов; все они могут быть получены из азотной кислоты или ее солей.
Оксид
 , или закись азота,
, или закись азота,
 получается при нагревании нитрата аммония:
получается при нагревании нитрата аммония:
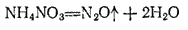
Оксид азота (I) представляет собою бесцветный газ со слабым запахом и сладковатым вкусом. Он мало растворим в воде: один объем воды при
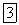 растворяет 0,63 объема
растворяет 0,63 объема
 .
.
Оксид азота
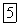 - термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна
- термодинамически неустойчивое соединение. Стандартная энергия Гиббса его образования положительна
 . Однако вследствие большой прочности связей в молекуле
. Однако вследствие большой прочности связей в молекуле
 энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада
энергии активации реакций, протекающих с участием этого вещества, высоки. В частности, высока энергия активации распада
 . Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
. Поэтому при комнатной температуре оксид азота (I) устойчив. Однако при повышенных температурах он разлагается на азот и кислород; разложение идет тем быстрее, чем выше температура.
Ни с водой, ни с кислотами, ни со щелочью оксид азота (I) не реагирует.
Электронная структура молекулы
 рассмотрена в § 41.
рассмотрена в § 41.
Вдыхание небольших количеств оксида азота (I) приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза.
Большие количества оксида
 действуют на нервную систему возбуждающе; поэтому раньше его называли «веселящим газом».
действуют на нервную систему возбуждающе; поэтому раньше его называли «веселящим газом».
Оксид
 , или окись азота,
, или окись азота,
 представляет собой бесцветный трудно сжижаемый газ. Жидкий оксид азота (II) кипит при
представляет собой бесцветный трудно сжижаемый газ. Жидкий оксид азота (II) кипит при
 и затвердевает при
и затвердевает при
 . В воде он мало растворим: 1 объем воды растворяет при
. В воде он мало растворим: 1 объем воды растворяет при
 всего 0,07 объема
всего 0,07 объема
 .
.
По химическим свойствам оксид азота (II) относится к числу безразличных оксидов, так как не образует никакой кислоты.
Подобно
 оксид азота (II) термодинамически
оксид азота (II) термодинамически
 стандартная энергия Гиббса его образования положительна (
стандартная энергия Гиббса его образования положительна (
 ). Но, опять-таки подобно
). Но, опять-таки подобно
 , при комнатной температуре
, при комнатной температуре
 не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше
не разлагается, потому что его молекулы достаточно прочны. Лишь при температурах выше
 его распад на азот и кислород начинает протекать с заметной скоростью. При очень высоких температурах, по причинам, рассмотренным в § 65, распад
его распад на азот и кислород начинает протекать с заметной скоростью. При очень высоких температурах, по причинам, рассмотренным в § 65, распад
 проходит не до конца — в системе
проходит не до конца — в системе
 устанавливается равновесие. Благодаря этому оксид азота (II) можно получить из простых веществ при температурах электрической дуги
устанавливается равновесие. Благодаря этому оксид азота (II) можно получить из простых веществ при температурах электрической дуги
 .
.
В лаборатории оксид азота (II) обычно получают взаимодействием 30—35 %-ной азотной кислоты с медью:
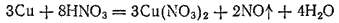
В промышленности он является промежуточным продуктом при производстве азотной кислоты (см. § 143).
Для оксида азота (II) характерна окислительно-восстановительная двойственность. Под действием сильных окислителей он окисляется, а в присутствии сильных восстановителей — восстанавливается. Например, он легко окисляется кислородом воздуха до диоксида азота:
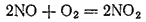
В то же время смесь равных объемов
 и
и
 при нагревании взрывает:
при нагревании взрывает:
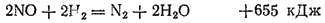
Электронная структура молекулы
 лучше всего описывается методом МО. На рис. 116 представлена схема заполнения МО в молекуле
лучше всего описывается методом МО. На рис. 116 представлена схема заполнения МО в молекуле
 . с аналогичными схемами для молекул
. с аналогичными схемами для молекул
 и СО — рис. 51 и 53 на стр. 142 и 143). Молекула
и СО — рис. 51 и 53 на стр. 142 и 143). Молекула
 имеет на один электрон больше, чем молекулы
имеет на один электрон больше, чем молекулы
 и СО: этот электрон находится на разрыхляющей орбитали
и СО: этот электрон находится на разрыхляющей орбитали
 . Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2 = 2,5). Действительно, энергия диссоциации молекулы
. Таким образом, число связывающих электронов превышает здесь число разрыхляющих на пять. Это соответствует кратности связи 2,5 (5:2 = 2,5). Действительно, энергия диссоциации молекулы
 на атомы
на атомы
 имеет промежуточное значение по сравнению с соответствующими величинами для молекулы 02 (498
имеет промежуточное значение по сравнению с соответствующими величинами для молекулы 02 (498
 ), в которой кратность связи равна двум, и молекулы
), в которой кратность связи равна двум, и молекулы
 , где связь тройная.
, где связь тройная.
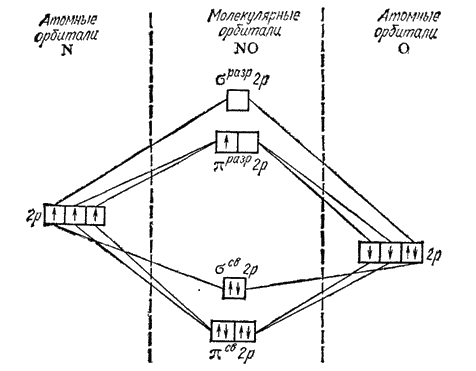
Рис. 116. Энергетическая схема образования молекулы
 .
.
Вместе с тем, по энергии диссоциации молекула
 близка к молекулярному иону кислорода
близка к молекулярному иону кислорода
 , в котором кратность связи также равна 2,5 (см. стр. 142).
, в котором кратность связи также равна 2,5 (см. стр. 142).
При отрыве от молекулы
 одного электрона образуется
одного электрона образуется
 , не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона
, не содержащий разрыхляющих электронов; кратность связи между атомами возрастает при этом до трех (шесть связывающих электронов). Поэтому энергия диссоциации иона
 выше энергии диссоциации молекулы
выше энергии диссоциации молекулы
 и близка к соответствующей величине для молекулы СО (1076
и близка к соответствующей величине для молекулы СО (1076
 ), в которой кратность связи равна трем. v Диоксид (или двуокись) азота
), в которой кратность связи равна трем. v Диоксид (или двуокись) азота
 — бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21
— бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21
 ), которая при охлаждении постепенно светлеет и при
), которая при охлаждении постепенно светлеет и при
 замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при
замерзает, образуя бесцветную кристаллическую массу. При нагревании газообразного диоксида азота его окраска, наоборот, усиливается, а при
 становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле
становится почти черной. Изменение окраски диоксида азота при повышении температуры сопровождается и изменением его молекулярной массы. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле
 . С повышением температуры плотность пара уменьшается и при
. С повышением температуры плотность пара уменьшается и при
 соответствует формуле
соответствует формуле
 . Бесцветные кристаллы, существующие при —
. Бесцветные кристаллы, существующие при —
 и ниже, состоят из молекул
и ниже, состоят из молекул
 . По мере нагревания молекулы
. По мере нагревания молекулы
 диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при
диссоциируют с образованием молекул темно-бурого диоксида азота; полная диссоциация происходит при
 .
.
Таким образом, при температурах от —11,2 до
 молекулы
молекулы
 и
и
 находятся в равновесии друг с другом:
находятся в равновесии друг с другом:
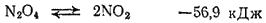
Выше
 начинается диссоциация
начинается диссоциация
 на
на
 и кислород.
и кислород.
Диоксид азота — очень энергичный окислитель. Многие вещества могут гореть в атмосфере
 , отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитрозный метод получения серной кислоты (см. § 131).
, отнимая от него кислород. Диоксид серы окисляется им в триоксид, на чем основан нитрозный метод получения серной кислоты (см. § 131).
Пары
 ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде
 вступает в реакцию с водой, образуя азотную и азотистую кислоты.
вступает в реакцию с водой, образуя азотную и азотистую кислоты.
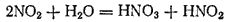
Поэтому диоксид азота можно считать смешанным ангидридом этих кислот.
Но азотистая кислота очень нестойка и быстро разлагается:
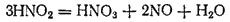
Поэтому практически взаимодействие диоксида азота с
 особенно с горячей, идет согласно уравнению
особенно с горячей, идет согласно уравнению
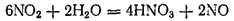
которое можно получить сложением двух предыдущих уравнений, если предварительно первое из них умножить на три.
В присутствии воздуха образующийся оксид азота немедленно окисляется в диоксид азота, так что в этом случае
 в конечном итоге полностью переходит в азотную кислоту:
в конечном итоге полностью переходит в азотную кислоту:
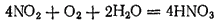
Эта реакция используется в современных способах получения азотной кислоты.
Если растворять диоксид азота в щелочах, то образуется смесь солей азотной и азотистой кислот, например:
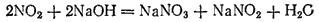
Оксид
 , или азотистый ангидрид,
, или азотистый ангидрид,
 представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на
представляет собой темно-синюю жидкость, уже при низких температурах разлагающуюся на
 и
и
 . Смесь равных объемов
. Смесь равных объемов
 и
и
 при охлаждении вновь образует
при охлаждении вновь образует
 :
:
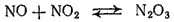
Оксиду
 соответствует азотистая кислота
соответствует азотистая кислота
 .
.
Оксид азота (V), или азотный ангидрид,
 белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на
белые кристаллы, уже при комнатной температуре постепенно разлагающиеся на
 и
и
 .
.
Он может быть получен действием фосфорного ангидрида на азотную кислоту:
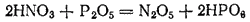
Оксид азота (V) — очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. В воде оксид
 хорошо растворяется с образованием азотной кислоты.
хорошо растворяется с образованием азотной кислоты.
В твердом состоянии
 образован нитратным ионом
образован нитратным ионом
 и ионом нитрония
и ионом нитрония
 . Последний содержит такое же число электронов, что и молекула
. Последний содержит такое же число электронов, что и молекула
 и, подобно последней, имеет линейное строение:
и, подобно последней, имеет линейное строение:
 . В парах молекула
. В парах молекула
 симметрична; ее строение может быть представлено следующей валентной схемой, в которой пунктиром показаны трехцентровые связи
симметрична; ее строение может быть представлено следующей валентной схемой, в которой пунктиром показаны трехцентровые связи
 с валентной схемой молекулы азотной кислоты на стр. 134):
с валентной схемой молекулы азотной кислоты на стр. 134):
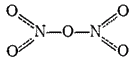
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
