121. Соединения галогенов с водородом.
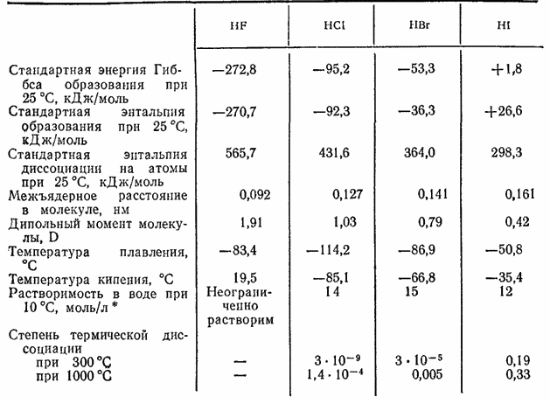
Из соединений галогенов наиболее важное практическое значение имеют галогеноводороды и соли галогеноводородов.Химическая связь в молекулах галогеноводородов — полярная ковалентная: общая электронная пара смещена к атому галогена как более электроотрицательному. Некоторые свойства галогеноводородов приведены в табл. 24.
Прочность химической связи в молекулах галогеноводородов закономерно падает в ряду
 : это проявляется в изменений энтальпии диссоциации молекул на атомы (табл. 24). Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов (см. § 118). Как показывает схема (рис. 107), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F—Cl—Br—I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах
: это проявляется в изменений энтальпии диссоциации молекул на атомы (табл. 24). Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов (см. § 118). Как показывает схема (рис. 107), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F—Cl—Br—I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах
 и
и
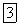 все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами.
все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами.
С уменьшением прочности связи в молекулах галогеноводородов падает и их устойчивость к нагреванию. Термическая диссоциация фтороводорода происходит лишь при очень высоких температурах (более 3500
 ), тогда как иодоводород уже при
), тогда как иодоводород уже при
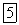 значительной степени распадается на иод и водород:
значительной степени распадается на иод и водород:
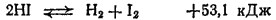
Все галогеноводороды — бесцветные газы с резким запахом.
Таблица 24. Некоторые свойства галогеноводородов
Галогеноводороды очень хорошо растворимы в воде. При
 один объем воды растворяет около 500 объемов
один объем воды растворяет около 500 объемов
 , 600 объемов
, 600 объемов
 и около 425 объемов HI (при
и около 425 объемов HI (при
 ); фтороводород смешивается с водой в любых соотношениях.
); фтороводород смешивается с водой в любых соотношениях.
Растворение галогеноводородов сопровождается их диссоциацией по кислотному типу, причем только фтороводород диссоциирован сравнительно слабо, остальные же принадлежат к числу наиболее сильных кислот.
На воздухе концентрированные растворы галогеноводородов дымят вследствие выделения галогеноводородов, образующих с водяными парами воздуха туман, который состоит из мелких капелек соответствующих кислот.

Рис. 107. Схема перекрывания электронных облаков при образовании молекул HF и НI. Пунктиром условно показано смещение электронного облака атома водорода в сторону атома галогена.
В ряду
 температуры кипения и плавления изменяются весьма закономерно (табл. 24), тогда как при переходе к HF они резко возрастают. Как уже говорилось в § 47, это обусловлено ассоциацией молекул фтороводорода в результате возникновения между ними водородных связей. Как показывает определение плотности пара, вблизи температуры кипения газообразный фтороводород состоит из агрегатов, имеющих средний состав
температуры кипения и плавления изменяются весьма закономерно (табл. 24), тогда как при переходе к HF они резко возрастают. Как уже говорилось в § 47, это обусловлено ассоциацией молекул фтороводорода в результате возникновения между ними водородных связей. Как показывает определение плотности пара, вблизи температуры кипения газообразный фтороводород состоит из агрегатов, имеющих средний состав
 . При дальнейшем нагревании эти агрегаты постепенно распадаются, причем лишь около
. При дальнейшем нагревании эти агрегаты постепенно распадаются, причем лишь около
 газообразный HF состоит из простых молекул.
газообразный HF состоит из простых молекул.
При растворении в воде молекулы фтороводорода диссоциируют с образованием ионов
 и
и
 . При этом частично разрываются водородные связи, так что диссоциация HF на ионы требует значительной затраты энергии. Поэтому фтороводород диссоциирует в водных растворах в значительно меньшей степени, чем другие галогеноводороды, константа диссоциации фтороводорода равна
. При этом частично разрываются водородные связи, так что диссоциация HF на ионы требует значительной затраты энергии. Поэтому фтороводород диссоциирует в водных растворах в значительно меньшей степени, чем другие галогеноводороды, константа диссоциации фтороводорода равна
 так что по силе эта кислота лишь ненамного превосходит уксусную.
так что по силе эта кислота лишь ненамного превосходит уксусную.
Образовавшиеся при диссоциации HF ионы
 в значительной степени связываются с недиссоциированными молекулами HF, причем образуется
в значительной степени связываются с недиссоциированными молекулами HF, причем образуется
 , в котором атомы фтора связаны друг с другом водородной связью:
, в котором атомы фтора связаны друг с другом водородной связью:
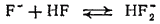
Поэтому при нейтрализации фтороводорода сначала образуются кислые соли, например,
 .
.
Отрицательные ионы галогеноводородов, за исключением фторид-иона, обладают восстановительными свойствами, возрастающими по ряду
 , I-.
, I-.
Хлорид-ион окисляется фтором, перманганатом калия, диоксидом марганца и другими сильными окислителями, например:
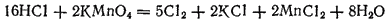
Еще легче окисляются бромид- и, в особенности, иодид-ионы. Последние также легко окисляются бромом, нитратами, солями
 , например:
, например:
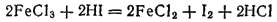
Поскольку галогенид-ионы обладают восстановительными свойствами, то при действии галогеноводородов на металлы последние могут окисляться лишь ионами водорода
 . Поэтому галогеноводороды могут реагировать в растворе только с металлами, стоящими в ряду напряжений до водорода.
. Поэтому галогеноводороды могут реагировать в растворе только с металлами, стоящими в ряду напряжений до водорода.
Раствор фтороводорода в воде называется плавиковой кислотой. Это название происходит от плавикового шпата, из которого обычно получают фтороводород действием концентрированной серной кислоты:
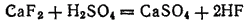
Продажный раствор фтороводорода содержит обычно
 . Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся соль малорастворима, вследствие чего на поверхности металла образуется защитная пленка. Так ведет себя, в частности, свинец, что и позволяет использовать его для изготовления аппаратуры, устойчивой к действию
. Фтороводород реагирует с большинством металлов. Однако во многих случаях образующаяся соль малорастворима, вследствие чего на поверхности металла образуется защитная пленка. Так ведет себя, в частности, свинец, что и позволяет использовать его для изготовления аппаратуры, устойчивой к действию
 .
.
Соли фтороводорода называются фторидами. Большинство их малорастворимы в воде; хорошо растворимы лишь фториды
 , К,
, К,
 и
и
 . Все соли плавиковой кислоты ядовиты.
. Все соли плавиковой кислоты ядовиты.
Замечательным свойством фтороводорода и плавиковой кислоты является их способность взаимодействовать с диоксидом кремния
 , входящим в состав стекла; в результате образуется газообразный фторид кремния
, входящим в состав стекла; в результате образуется газообразный фторид кремния
 :
:
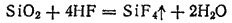
В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами HF с образованием хорошо растворимой комплексной гексафторокремниевой (кремнефтороводородной) кислоты:
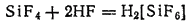
На взаимодействии HF с диоксидом кремния основано применение плавиковой кислоты для вытравливания на стекле различных меток, надписей и рисунков.
Ввиду того, что фтороводород разрушает стекло, в лаборатории его хранят в сосудах из специальных сортов пластмасс. Его можно хранить также в сосудах из свинца или в стеклянных сосудах, покрытых изнутри слоем парафина.
Применение фтороводорода довольно разнообразно. Безводный HF используют, главным образом, при органических синтезах, а плавиковую кислоту — при получении фторидов, травлении стекла, удалении песка с металлических отливок, при анализах минералов.
Пары фтороводорода очень ядовиты. Попадая на кожу, концентрированная плавиковая кислота вызывает тяжелые ожоги.
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
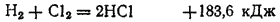
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции.
Исходным сырьем для получения хдороводорода служат хлор и водород, образующиеся при электролизе раствора
 (§ 197).
(§ 197).
Большие количества
 получают также в качестве побочного продукта хлорирования органических соединений согласно схеме
получают также в качестве побочного продукта хлорирования органических соединений согласно схеме
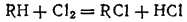
где R — органический радикал.
Соляная кислота — бесцветная жидкость с резким запахом. Обычно концентрированная соляная кислота содержит около
 , плотность ее
, плотность ее
 .
.
Прежний «сульфатный» метод получения
 , применяемый в настоящее время только в лабораторной практике, основан на взаимодействии
, применяемый в настоящее время только в лабораторной практике, основан на взаимодействии
 и концентрированной
и концентрированной
 согласно уравнениям:
согласно уравнениям:
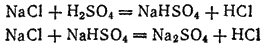
Первая из этих реакций протекает в значительной степени уже при слабом нагревании; вторая осуществляется лишь при более высоких температурах. В качестве побочного продукта получается сульфат натрия
 .
.
При нагревании концентрированной соляной кислоты вначале улетучивается хлороводород с небольшим количеством воды. Это происходит до тех пор, пока в остатке не получится
 -ный раствор; последний перегоняется уже без изменения состава при постоянной температуре
-ный раствор; последний перегоняется уже без изменения состава при постоянной температуре
 . Наоборот, если нагревать разбавленную
. Наоборот, если нагревать разбавленную
 , то отгоняется преимущественно вода. Когда концентрация
, то отгоняется преимущественно вода. Когда концентрация
 в остатке достигает 20,2 %, жидкость начинает перегоняться без изменения состава, как и в предыдущем случае. Подобные растворы, характеризующиеся одинаковым составом жидкости и насыщенного пара и поэтому перегоняющиеся без изменения состава, называются постояннокипящимв или азеотропными растворами.
в остатке достигает 20,2 %, жидкость начинает перегоняться без изменения состава, как и в предыдущем случае. Подобные растворы, характеризующиеся одинаковым составом жидкости и насыщенного пара и поэтому перегоняющиеся без изменения состава, называются постояннокипящимв или азеотропными растворами.
Подобно другим сильным кислотам,
 энергично взаимодействует со многими металлами и оксидами металлов. Соли ее называются хлоридами. Большинство их хорошо растворимы в воде. Малорастворимы
энергично взаимодействует со многими металлами и оксидами металлов. Соли ее называются хлоридами. Большинство их хорошо растворимы в воде. Малорастворимы
 .
.
Соляная кислота — одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие ее соли. Отметим важнейшие из хлоридов.
Хлорид натрия
 , или поваренная соль, служит сырьем для получения хлора, соляной кислоты, едкого натра и карбоната натрия (соды), применяется в красильном деле, в мыловарении и во многих других производствах. Он служит также приправой к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
, или поваренная соль, служит сырьем для получения хлора, соляной кислоты, едкого натра и карбоната натрия (соды), применяется в красильном деле, в мыловарении и во многих других производствах. Он служит также приправой к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
Хлорид калия
 в больших количествах потребляется сельским хозяйством в качестве удобрения.
в больших количествах потребляется сельским хозяйством в качестве удобрения.
Хлорид кальция
 употребляется для приготовления охлаждающих смесей. Безводный
употребляется для приготовления охлаждающих смесей. Безводный
 широко применяют в лабораторной практике для осушения газов и обезвоживания жидких органических веществ.
широко применяют в лабораторной практике для осушения газов и обезвоживания жидких органических веществ.
Хлорид
 , или сулема, очень сильный яд. Разбавленные растворы сулемы
, или сулема, очень сильный яд. Разбавленные растворы сулемы
 используются в медицине как сильнодействующее дезинфицирующее средство (см. также стр. 607).
используются в медицине как сильнодействующее дезинфицирующее средство (см. также стр. 607).
Хлорид серебра
 — наименее растворимая соль соляной кислоты. Образование осадка
— наименее растворимая соль соляной кислоты. Образование осадка
 при взаимодействии ионов
при взаимодействии ионов
 с ионами
с ионами
 служит характерной реакцией на хлорид-ионы. Хлорид серебра применяют в фотографической промышленности при изготовлении светочувствительных материалов.
служит характерной реакцией на хлорид-ионы. Хлорид серебра применяют в фотографической промышленности при изготовлении светочувствительных материалов.
Бромоводород и иодоводород очень похожи по своим свойствам на хлороводород, но отличаются более выраженными восстановительными свойствами. Молекулярный кислород постепенно окисляет иодоводород уже при комнатной температуре, причем под действием света реакция сильно ускоряется:
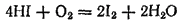
Бромоводород взаимодействует с кислородом гораздо медленнее, в то время как при обычных условиях соляная кислота вовсе с ним не взаимодействует.
Восстановительные свойства бромоводорода и иодоводорода заметно проявляются и при взаимодействии с концентрированной серной кислотой. При этом
 восстанавливает
восстанавливает
 до
до
 :
:
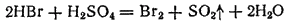
а
 — до свободной серы или даже до
— до свободной серы или даже до
 :
:
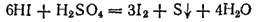
или
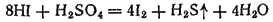
Поэтому
 трудно, a HI практически невозможно получить действием серной кислоты на бромиды или иодиды. Обычно эти галогеноводороды получают действием воды на соединения брома и иода с фосфором —
трудно, a HI практически невозможно получить действием серной кислоты на бромиды или иодиды. Обычно эти галогеноводороды получают действием воды на соединения брома и иода с фосфором —
 и
и
 . Последние подвергаются при этом полному гидролизу, образуя фосфористую кислоту и соответствующий галогеноводород:
. Последние подвергаются при этом полному гидролизу, образуя фосфористую кислоту и соответствующий галогеноводород:
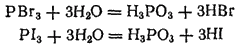
Раствор иодоводорода (вплоть до
 -ной концентрации) можно получить, пропуская
-ной концентрации) можно получить, пропуская
 в водную суспензию иода. Реакция идет согласно схеме:
в водную суспензию иода. Реакция идет согласно схеме:
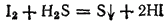
Соли бромоводорода и иодоводорода называются соответственно бромидами и йодидами. Растворимость бромидов и иодидов в большинстве случаев подобна растворимости соответствующих хлоридов.
Растворы бромидов натрия и калия под химически неправильным названием «бром» применяются в медицине как успокаивающее средство при расстройствах нервной системы. Бромид серебра в больших количествах идет на изготовление фотоматериалов. Иодид калия применяют в медицине — в частности, при заболеваниях эндокринной системы.
| << Предыдущий параграф | Следующий параграф >> |
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
