209. Бериллий (Beryllium).
Бериллий мало распространен в земной коре . Он входит в состав некоторых минералов, из которых чаще всего встречается берилл
. Он входит в состав некоторых минералов, из которых чаще всего встречается берилл
 . Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
. Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
Металлический бериллий получают электролизом расплавов его соединений, главным образом хлорида бериллия. Электролитом служит расплав, содержащий
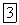 (масс.)
(масс.)
 и
и
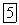 (масс.)
(масс.)
 использование расплава такого состава позволяет понизить температуру, при которой проводят электролиз, до
использование расплава такого состава позволяет понизить температуру, при которой проводят электролиз, до
 (чистый хлорид бериллия плавится при
(чистый хлорид бериллия плавится при
 ).
).
Бериллий очень твердый, хрупкий, белый, легкий металл. Он коррозионно стоек вследствие образования на его поверхности оксидной пленки, обладающей защитными свойствами. Вода почти не действует на бериллий; в кислотах же он легко растворяется с выделением водорода.
Для бериллия характерно, что в водных растворах щелочей он тоже растворяется; при этом образуются гидроксобериллаты:
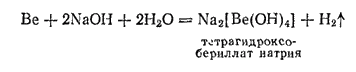
Металлический бериллий обладает многими замечательными свойствами. Тонкие пластинки бериллия хорошо пропускают рентгеновские лучи и служат незаменимым материалом для изготовления окошек рентгеновских трубок, через которые лучи выходят наружу. Главной областью применения бериллия являются сплавы, в которые этот металл вводится как легирующая добавка. Кроме бериллиевых бронз (см. § 200), применяются сплавы никеля с
 , которые по коррозионной стойкости, прочности и упругости сравнимы с высококачественными нержавеющими сталями, а в некоторых отношениях превосходят их. Они применяются для изготовления пружин и хирургических инструментов. Небольшие добавки бериллия к магниевым сплавам повышают их коррозионную стойкость. Такие сплавы, а также сплавы алюминия с бериллием применяются в авиастроении. Бериллий — один из лучших замедлителей и отражателей нейтронов в высокотемпературных ядерных реакторах.
, которые по коррозионной стойкости, прочности и упругости сравнимы с высококачественными нержавеющими сталями, а в некоторых отношениях превосходят их. Они применяются для изготовления пружин и хирургических инструментов. Небольшие добавки бериллия к магниевым сплавам повышают их коррозионную стойкость. Такие сплавы, а также сплавы алюминия с бериллием применяются в авиастроении. Бериллий — один из лучших замедлителей и отражателей нейтронов в высокотемпературных ядерных реакторах.
В связи с ценными свойствами бериллия производство его быстро растет.
Как уже указывалось, второй снаружи электронный слой атома бериллия построен иначе, чем у остальных элементов подгруппы: он содержит не восемь, а только два электрона. Поэтому, в сравнении с другими элементами подгруппы (см. табл. 32), радиус атома, а в особенности иона, бериллия непропорционально мал, энергия его ионизации велика, а кристаллическая решетка очень прочна (высокая температура плавления и большая энтальпия атомизации).
Отличие строения атома бериллия от строения атома магния и щелочноземельных элементов сказывается и на свойствах его соединений. Так,
 — единственное в подгруппе основание, обладающее амфотерными свойствами (см. ниже). Кроме того, для щелочноземельных металлов и магния характерно образование ионных соединений, тогда как атомы бериллия обычно связаны с атомами других элементов скорее ковалентной связью, чем ионной.
— единственное в подгруппе основание, обладающее амфотерными свойствами (см. ниже). Кроме того, для щелочноземельных металлов и магния характерно образование ионных соединений, тогда как атомы бериллия обычно связаны с атомами других элементов скорее ковалентной связью, чем ионной.
По своим химическим свойствам бериллий в значительной степени сходен с алюминием, находящимся в третьем периоде и в третьей группе периодической системы, т. е. правее и ниже бериллия. Это явление, носящее название диагонального сходства, наблюдается не только у бериллия, но и у некоторых других элементов. Например, бор по многим химическим свойствам сходен с кремнием.
При образовании соединений типа
 , например
, например
 , атомы бериллия переходят в возбужденное состояние:
, атомы бериллия переходят в возбужденное состояние:
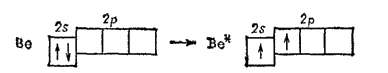
При этом за счет распаривания электронов образуются две ковалентные связи и происходит
 -гибридизация: валентные электроны образуют два равноценных
-гибридизация: валентные электроны образуют два равноценных
 -гибридных облака, вытянутых в противоположных направлениях. Таким образом, молекулы
-гибридных облака, вытянутых в противоположных направлениях. Таким образом, молекулы
 имеют линейное строение. Более подробно
имеют линейное строение. Более подробно
 -гибридизация орбиталей в атоме бериллия рассмотрена в § 43; см. также рис. 39 на стр. 130.
-гибридизация орбиталей в атоме бериллия рассмотрена в § 43; см. также рис. 39 на стр. 130.
Общее число валентных электронов в молекулах, подобных
 , недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Поэтому такие молекулы называют электронодефицитными. Так, в молекуле
, недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Поэтому такие молекулы называют электронодефицитными. Так, в молекуле

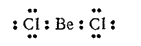
в наружном слое атома бериллия находятся всего четыре электрона.
Поэтому атом бериллия способен быть акцептором электронных пар и образовывать еще две ковалентные связи по донорно-акцепторному способу. В то же время каждый атом хлора, входящий в состав молекулы
 , обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами
, обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами
 возникают новые ковалентные связи в соответствии со схемой:
возникают новые ковалентные связи в соответствии со схемой:
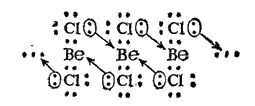
В итоге, при конденсации хлорида бериллия образуются линейные полимерные цепи, в которых атомы хлора играют роль мостиков, связывающих атомы бериллия. Атомы, выполняющие такую функцию, называются мостиков
 атомами. Схема строения линейного полимера
атомами. Схема строения линейного полимера
 изображена на рис. 163. Видно, что ковалентность и координационное число бериллия в твердом
изображена на рис. 163. Видно, что ковалентность и координационное число бериллия в твердом
 равны четырем.
равны четырем.
Это значение ковалентности и координационного числа характерно для многих устойчивых соединений бериллия. Так, при взаимодействии
 с фторидами щелочных металлов образуются комплексные фторобериллаты, содержащие
с фторидами щелочных металлов образуются комплексные фторобериллаты, содержащие
 , например:
, например:
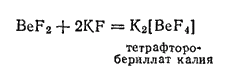
Здесь атом бериллия находится в состоянии
 , благодаря чему
, благодаря чему
 построен в форме тетраэдра. Тетраэдрическое расположение атомов бериллия и кислорода
построен в форме тетраэдра. Тетраэдрическое расположение атомов бериллия и кислорода
 терно и для кристаллического оксида бериллия. В водных растворах
терно и для кристаллического оксида бериллия. В водных растворах
 бериллия, по-видимому, находится также в виде
бериллия, по-видимому, находится также в виде
 эдрических аквакомплексов
эдрических аквакомплексов
 .
.
Оксид бериллия
 — белое, очень тугоплавкое вещество. Применяется в качестве химически устойчивого огнеупорного материала (в реактивных двигателях, для изготовления тиглей, в электротехнике) и как конструкционный материал в ядерных реакторах.
— белое, очень тугоплавкое вещество. Применяется в качестве химически устойчивого огнеупорного материала (в реактивных двигателях, для изготовления тиглей, в электротехнике) и как конструкционный материал в ядерных реакторах.
Гидроксид бериллия
 имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов щелочноземельных металлов.
имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов щелочноземельных металлов.
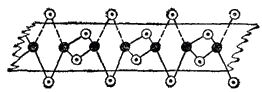
Рис. 163. Схема строения линейного полимера
 : черные кружки - атомы алюминия, светлые — атомы хлора.
: черные кружки - атомы алюминия, светлые — атомы хлора.
В воде он практически нерастворим, но легко растворяется как в кислотах, так и в щелочах, в последнем случае с образованием гидроксоберпллатов:
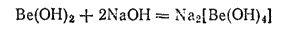
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидролизуются.
Большинство солей бериллия, в том числе и сульфат, хорошо растворимы в воде, тогда как сульфаты щелочноземельных металлов в воде практически нерастворимы. В водных растворах ионы
 подвергаются гидролизу, благодаря чему растворы солей бериллия имеют кислую реакцию.
подвергаются гидролизу, благодаря чему растворы солей бериллия имеют кислую реакцию.
Все соединения бериллия токсичны. В частности, весьма опасно пребывание в атмосфере, содержащей пыль бериллия или его соединений.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
