70. Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до плотность ее также увеличивается.
плотность ее также увеличивается.
При
 вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до
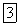 и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру
и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру
 . Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при
. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при
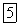 , то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Большое значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью
 . Поэтому в ночное время, а также при переходе от лета к эиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь таким образом, регулятором температуры на земном шаре.
. Поэтому в ночное время, а также при переходе от лета к эиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь таким образом, регулятором температуры на земном шаре.
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при
 . При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при
. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при
 вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине —ядро атома кислорода. Межъядерные расстояния
 близки к
близки к
 , расстояние между ядрами атомов водорода равно примерно
, расстояние между ядрами атомов водорода равно примерно
 . Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды
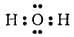
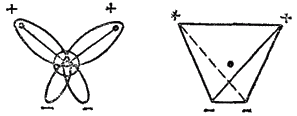
Рис. 71. Схема строения молекулы воды.
Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи
 , а остальные четыре электрона представляют собой две неподеленных электронных пары.
, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Как уже указывалось на стр. 132, атом кислорода в молекуле воды находится в состоянии
 -гибридизации. Поэтому валентный угол НОН
-гибридизации. Поэтому валентный угол НОН
 близок к тетраэдрическому
близок к тетраэдрическому
 . Электроны, образующие связи
. Электроны, образующие связи
 , смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных
, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных
 -орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71).
-орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71).
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях (см. § 80), оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е., соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды (см. рис. 57 на стр. 148). Как уже говорилось в § 47, ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме
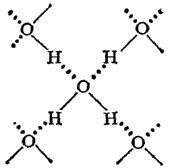
в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рис. 72. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя.
Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы
 .
.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до
 этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше
этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше
 преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при
преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при
 вода обладает максимальной плотностью.
вода обладает максимальной плотностью.
При нагревании воды часть теплоты затрачивается на разрыв водородных связей (энергия разрыва водородной связи в воде составляет примерно 25
 ). Этим объясняется высокая теплоемкость воды.
). Этим объясняется высокая теплоемкость воды.
Водородные связи между молекулами воды полностью разрываются только при переходе воды в пар.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
