137. Аммиак. Соли аммония.
Азот образует несколько соединений с водородом; из них наибольшее значение имеет аммиак — бесцветный газ с характерным резким запахом (запах «нашатырного спирта»).
В лаборатории аммиак обычно получают, нагревая хлорид аммония
 с гашеной известью
с гашеной известью
 . Реакция выражается уравнением
. Реакция выражается уравнением
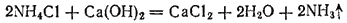
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
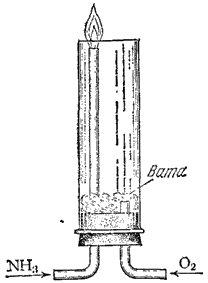
Рис. 114. Прибор для демонстрации горения аммиака в кислороде.
Масса 1 л аммиака при нормальных условиях равна 0,77 г. Поскольку этот газ значительно легче воздуха, то его можно собирать в перевернутые вверх дном сосуды.
При охлаждении до
 аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при
аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при
 .
.
Электронная структура и пространственное строение молекулы аммиака рассмотрены в § 43. В жидком аммиаке молекулы
 связаны между собой водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака
связаны между собой водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака
 , не соответствующую его малой молекулярной массе (17).
, не соответствующую его малой молекулярной массе (17).
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит
 (масс.)
(масс.)
 и имеет плотность
и имеет плотность
 . Раствор аммиака в воде иногда называют нашатырным спиртом. Обычный медицинский нашатырный спирт содержит
. Раствор аммиака в воде иногда называют нашатырным спиртом. Обычный медицинский нашатырный спирт содержит
 . С повышением температуры, растворимость аммиака уменьшается, поэтому он выделяется при нагревании из концентрированного раствора, чем иногда пользуются в лабораториях для получения небольших количеств газообразного аммиака.
. С повышением температуры, растворимость аммиака уменьшается, поэтому он выделяется при нагревании из концентрированного раствора, чем иногда пользуются в лабораториях для получения небольших количеств газообразного аммиака.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат
 , плавящийся при —
, плавящийся при —
 . Известен также кристаллогидрат состава
. Известен также кристаллогидрат состава
 . В этих гидратах молекулы воды и аммиака соединены между собой водородными связями.
. В этих гидратах молекулы воды и аммиака соединены между собой водородными связями.
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. В аммиаке азот имеет самую низкую степень окисленности
 . Поэтому аммиак обладает только восстановительными свойствами. Если пропускать ток
. Поэтому аммиак обладает только восстановительными свойствами. Если пропускать ток
 по трубке, вставленной в другую широкую трубку (рис. 114), по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
по трубке, вставленной в другую широкую трубку (рис. 114), по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
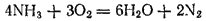
При других условиях аммиак может окисляться до оксида азота
 (см. § 143).
(см. § 143).
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не обладает кислотными свойствами. Однако атомы водорода в его молекуле могут замещаться атомами металлов.
При полном замещении водорода металлом образуются соединения, называемые нитридами. Некоторые из них, например нитриды кальция и магния, получаются при непосредственном взаимодействии азота с металлами при высокой температуре;
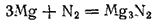
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла. Например:
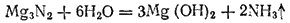
При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия
 в виде бесцветных кристаллов:
в виде бесцветных кристаллов:
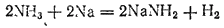
Вода разлагает амид натрия;
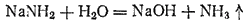
Обладая сильными основными и водоотнимающими свойствами, амид натрия нашел применение при некоторых органических синтезах, например, в производстве красителя индиго и некоторых лекарственных препаратов.
Водород в аммиаке может замещаться также галогенами. Так, при действии хлора на концентрированный раствор хлорида аммония получается нитрид хлора, или хлористый азот,

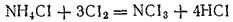
в виде тяжелой маслянистой взрывчатой жидкости.
Подобными же свойствами обладает нитрид иода (иодистый азот), образующийся в виде черного, нерастворимого в воде порошка при действии иода на аммиак. Во влажном состоянии он безопасен, но высушенный взрывается от малейшего прикосновения; при этом выделяются пары иода фиолетового цвета.
С фтором азот образует устойчивый фторид азота
 .
.
Из данных табл. 6 (стр. 118) видно, что электроотрицательность хлора и пода меньше, а фтора больше, чем электроотрицательность азота. Отсюда следует, что в соединениях
 и
и
 степень окисленности азота равна —3, а в
степень окисленности азота равна —3, а в
 она равна
она равна
 . Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою
. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, при взаимодействии с водою
 или
или
 образуется аммиак, а в случае
образуется аммиак, а в случае
 получается оксид азота (III);
получается оксид азота (III);
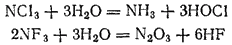
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную электронную пару:
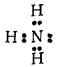
Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно-акцепторному способу четвертой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами.
Этим объясняется чрезвычайно характерная для аммиака способность вступать в реакции присоединения.
Примеры сложных (комплексных) соединений, образуемых аммиаком в результате реакций присоединения, приведены в
 и 201, а также в гл. XVIII. Выше (стр. 124) уже было рассмотрено взаимодействие молекулы
и 201, а также в гл. XVIII. Выше (стр. 124) уже было рассмотрено взаимодействие молекулы
 с ионом водорода, приводящее к образованию иона аммония
с ионом водорода, приводящее к образованию иона аммония
 :
:
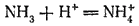
В этой реакции аммиак служит акцептором протона и, следовательно, с точки зрения протонной теории кислот и оснований (стр. 237) проявляет свойства основания. Действительно, реагируя с кислотами, находящимися в свободном состоянии или в растворе, аммиак нейтрализует их, образуя соли аммония. Например, с соляной кислотой получается хлорид аммония
 :
:
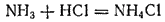
Взаимодействие аммиака с водой тоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
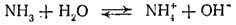
В результате концентрация ионов
 в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако по установившейся традиции водный раствор аммиака обычно обозначают формулой
в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако по установившейся традиции водный раствор аммиака обычно обозначают формулой
 и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат диссоциации молекул
и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат диссоциации молекул
 .
.
Аммиак — слабое основание. При
 константа равновесия его ионизации (см. предыдущее уравнение) равна
константа равновесия его ионизации (см. предыдущее уравнение) равна
 . В
. В
 одномолярного водного раствора аммиака содержится всего лишь 0,0042 эквивалента ионов
одномолярного водного раствора аммиака содержится всего лишь 0,0042 эквивалента ионов
 и
и
 ; такой раствор при
; такой раствор при
 имеет
имеет
 .
.
Большинство солей аммония бесцветны и хорошо растворимы в воде. По некоторым своим свойствам они подобны солям щелочных металлов, особенно калия (ионы
 и
и
 имеют близкие размеры).
имеют близкие размеры).
Поскольку водный раствор аммиака представляет собой слабое основание, то соли аммония в растворах гидролизуются. Растворы солей, образованных аммиаком и сильными кислотами, имеют слабокислую реакцию.
Гидролиз иона аммония обычно записывают в такой форме:
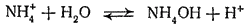
Однако правильнее рассматривать его как обратимый переход протона от иона аммония к молекуле воды:
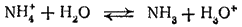
При добавлении щелочи к водному раствору какой-либо соли аммония ионы
 связываются ионами ОН- в молекулы воды и равновесие гидролиза смещается вправо. Происходящий при этом процесс можно выразить уравнением:
связываются ионами ОН- в молекулы воды и равновесие гидролиза смещается вправо. Происходящий при этом процесс можно выразить уравнением:
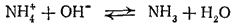
При нагревании раствора аммиак улетучивается, в чем нетрудно убедиться по запаху. Таким образом, присутствие любой аммонийной соли в растворе можно обнаружить, нагревая раствор со щелочью (реакция на
 аммония).
аммония).
Соли аммония термически неустойчивы. При нагревании они разлагаются. Это разложение может происходить обратимо или необратимо. Соли аммония, анион которых не является окислителем или лишь в слабой степени проявляет окислительные свойства, распадаются обратимо. Например, при нагревании хлорид аммония как бы возгоняется — разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
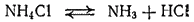
При обратимом распаде солей аммония, образованных нелетучими кислотами, улетучивается только аммиак. Однако продукты разложения — аммиак и кислота, — будучи смешаны, вновь соединяются друг с другом. Примерами могут служить реакции распада сульфата аммония
 или фосфата аммония
или фосфата аммония
 .
.
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает окислительно-восстановительная реакция, в ходе которой
 аммония окисляется, а анион восстанавливается. Примерами могут служить распад
аммония окисляется, а анион восстанавливается. Примерами могут служить распад
 (§ 136) или разложение нитрата аммония:
(§ 136) или разложение нитрата аммония:
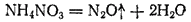
Аммиак и соли аммония находят широкое применение. Как уже говорилось, аммиак даже при невысоком давлении
 легко превращается в жидкость. Поскольку при испарении жидкого аммиака поглощается большое количество теплоты (1,37
легко превращается в жидкость. Поскольку при испарении жидкого аммиака поглощается большое количество теплоты (1,37
 ), то жидкий аммиак используется в различных холодильных устройствах.
), то жидкий аммиак используется в различных холодильных устройствах.
Водные растворы аммиака применяются в химических лабораториях и производствах как слабое легколетучее основание; их используют также в медицине и в быту. Но большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, а также других азотсодержащих веществ. К важнейшим из них относятся азотные удобрения, прежде всего сульфат и нитрат аммония и карбамид (стр. 427).
Сульфат аммония
 служит хорошим удобрением и производится в больших количествах.
служит хорошим удобрением и производится в больших количествах.
Нитрат аммония
 тоже применяется в качестве удобрения; процентное содержание усвояемого азота в этой соли выше, чем в других нитратах или солях аммония. Кроме того, нитрат аммония образует взрывчатые смеси с горючими веществами (аммоналы), применяемые для взрывных работ.
тоже применяется в качестве удобрения; процентное содержание усвояемого азота в этой соли выше, чем в других нитратах или солях аммония. Кроме того, нитрат аммония образует взрывчатые смеси с горючими веществами (аммоналы), применяемые для взрывных работ.
Хлорид аммония, или нашатырь,
 применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
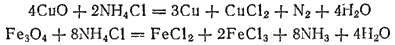
Первая из этих реакций является окислительно-восстановительной: медь, будучи менее активным металлом, чем железо, восстанавливается аммиаком, который образуется при нагревании
 .
.
Жидкий аммиак и насыщенные им растворы аммонийных солей применяют в качестве удобрений. Одним из главных преимуществ таких удобрений является повышенное содержание в них азота.
| << Предыдущий параграф | Следующий параграф >> |
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
