15. Важнейшие классы и номенклатура неорганических веществ.
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь, разделяются на металлы и неметаллы или металлоиды.Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические и неорганические: органическими принято называть соединенияуглерода все остальные вещества называются неорганическими (иногда минеральными).
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотсодержащие и т. д.), либо по химическим свойствам, т. е. по функциям (кислотно-основным, окислительно-восстановительным и т. д.), которые эти вещества осуществляют в химических реакциях, — по их функциональным признакам.
К важнейшим бинарным соединениям относятся соединения элементов с кислородом (оксиды), с галогенами (галоге-ниды или галиды), азотом (нитриды), углеродом (карбиды), а также соединения металлических элементов с водородом (гидриды). Их названия образуются из латинского корня названия более элетроотрицательного элемента с окончанием
 и русского названия менее электроотрицательного элемента в родительном падеже, причем в формулах бинарных соединений первым записывается символ менее электроотрицательного элемента. Например,
и русского названия менее электроотрицательного элемента в родительном падеже, причем в формулах бинарных соединений первым записывается символ менее электроотрицательного элемента. Например,
 — оксид серебра,
— оксид серебра,
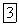 — фторид кислорода (фтор — более электроотрицательный элемент, чем кислород),
— фторид кислорода (фтор — более электроотрицательный элемент, чем кислород),
 — бромид калия,
— бромид калия,
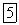 — нитрид магния,
— нитрид магния,
 — карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот, — см. ниже).
— карбид кальция (однако названия водородных соединений неметаллов, обладающих свойствами кислот, образуются по правилам, принятым для кислот, — см. ниже).
Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами степень его окисленности. Так,
 - оксид меди(I),
- оксид меди(I),
 оксид меди (II), СО — оксид углерода (II) — оксид углерода (IV),
оксид меди (II), СО — оксид углерода (II) — оксид углерода (IV),
 — фторид серы (VI). Можно также вместо степени окисленности указывать с помощью греческих числительных приставок (моно, ди, три, тетра, пента, гекса и т. д.) число атомов более электроотрицательного элемента в формуле соединения: СО — монооксид углерода (приставку «моно» часто опускают),
— фторид серы (VI). Можно также вместо степени окисленности указывать с помощью греческих числительных приставок (моно, ди, три, тетра, пента, гекса и т. д.) число атомов более электроотрицательного элемента в формуле соединения: СО — монооксид углерода (приставку «моно» часто опускают),
 — диоксид углерода,
— диоксид углерода,
 — гексафторид серы.
— гексафторид серы.
По функциональным признакам оксиды подразделяются на солеобразующие и несолеобразующие (безразличные). Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и амфотерные.
Основными называются оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, основные оксиды образуют основания. Например, оксид кальция
 реагирует с водой, образуя гидроксид кальция
реагирует с водой, образуя гидроксид кальция
 :
:
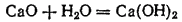
Оксид магния
 — тоже основной оксид. Он малорастворим в воде, но ему соответствует основание — гидроксид магния
— тоже основной оксид. Он малорастворим в воде, но ему соответствует основание — гидроксид магния
 , который можно получить из
, который можно получить из
 косвенным путем.
косвенным путем.
Кислотными называются оксиды, взаимодействующие с основаниями (или с основными оксидами) с образованием солей. Присоединяя (непосредственно или косвенно) воду, кислотные оксиды образуют кислоты. Так, триоксид серы
 взаимодействует с водой, образуя серную кислоту
взаимодействует с водой, образуя серную кислоту
 :
:
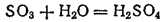
Диоксид кремния
 — тоже кислотный оксид. Хотя он не взаимодействует с водой, ему соответствует кремниевая кислота
— тоже кислотный оксид. Хотя он не взаимодействует с водой, ему соответствует кремниевая кислота
 , которую можно получить из
, которую можно получить из
 косвенным путем.
косвенным путем.
Один из способов получения кислотных оксидов — отнятие воды от соответствующих кислот. Поэтому кислотные оксиды иногда называют ангидридами кислот.
Амфотерными называются оксиды, образующие соли при взаимодействии как с кислотами, так и с основаниями. К таким оксидам относятся, например,
 . Явление амфотерности рассматривается в § 87.
. Явление амфотерности рассматривается в § 87.
Несолеобразующие оксиды, как видно из их названия, не способны взаимодействовать с кислотами или основаниями с образованием солей.
К ним относятся
 и некоторые другие оксиды.
и некоторые другие оксиды.
Существуют вещества — соединения элементов с кислородом, которые, относясь по составу к классу оксидов, по строению и свойствам относятся к классу солей. К таким веществам принадлежат, в частности, пероксиды металлов— например, пероксид бария
 . По своей природе пероксиды представляют собой соли очень слабой кислоты — пероксида (перекиси) водорода
. По своей природе пероксиды представляют собой соли очень слабой кислоты — пероксида (перекиси) водорода
 (см. § 117). К солеобразным соединениям относятся и такие вещества, как
(см. § 117). К солеобразным соединениям относятся и такие вещества, как
 и
и
 (§ 188).
(§ 188).
Среди многоэлементных соединений важную группу составляют гидроксиды — вещества, содержащие гидроксогруппы ОН. Некоторые из них (основные гидроксиды) проявляют свойства оснований —
 и т. п.; другие (кислотные гидроксиды) проявляют свойства кислот —
и т. п.; другие (кислотные гидроксиды) проявляют свойства кислот —
 и др.; существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства, -
и др.; существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства, -
 и т. п. Кислотные гидроксиды называются по правилам, установленным для кислот (см. ниже). Названия основных гидроксидов составляются из слова «гидроксид» и русского названия элемента в родительном падеже с указанием, если необходимо, степени окисленности элемента (римскими цифрами в скобках). Например,
и т. п. Кислотные гидроксиды называются по правилам, установленным для кислот (см. ниже). Названия основных гидроксидов составляются из слова «гидроксид» и русского названия элемента в родительном падеже с указанием, если необходимо, степени окисленности элемента (римскими цифрами в скобках). Например,
 — гидроксид лития,
— гидроксид лития,
 — гидроксид железа (II). Растворимые основные гидроксиды называются щелочами; важнейшие щелочи — гидроксид натрия
— гидроксид железа (II). Растворимые основные гидроксиды называются щелочами; важнейшие щелочи — гидроксид натрия
 , гидроксид калия КОН, гидроксид кальция
, гидроксид калия КОН, гидроксид кальция
 .
.
К важнейшим классам неорганических соединений, выделяемым по функциональным признакам, относятся кислоты, основания и соли.
Кислотами с позиций теории электролитической диссоциации (§ 82 и 87) называются вещества, диссоциирующие в растворах с образованием ионов водорода. С точки зрения протонной теории кислот и оснований (§ 87) к кислотам относятся вещества, способные отдавать ион водорода, т. е. быть донорами протонов.
Наиболее характерное химическое свойство кислот — их способность реагировать с основаниями (а также с основными и амфотернымн оксидами) с образованием солей, например:
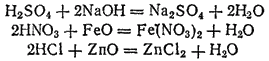
Кислоты классифицируют по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты. По силе кислоты делятся на сильные и слабые (§ 84). Важнейшие сильные кислоты — азотная
 , серная
, серная
 и соляная
и соляная
 . По наличию кислорода различают кислородсодержащие кислоты (
. По наличию кислорода различают кислородсодержащие кислоты (
 и т. п.) и бескислородные кислоты (
и т. п.) и бескислородные кислоты (
 и т. п.).
и т. п.).
По основности, т. е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяют на одноосновные (например,
 ,
,
 ), двухосновные
), двухосновные
 , трехосновные
, трехосновные
 и т. д.
и т. д.
Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например CN — циан) суффикс о и окончание водород:
 — хлороводород,
— хлороводород,
 — селеноводород, HCN — циановодород.
— селеноводород, HCN — циановодород.
Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисленности, оканчивается на ная или овая; например,
 — серная кислота,
— серная кислота,
 — хлорная кислота,
— хлорная кислота,
 — мышьяковая кислота. С понижением степени окисленности кислотообразующего элемента окончания изменяются в следующей последовательности: оватая (
— мышьяковая кислота. С понижением степени окисленности кислотообразующего элемента окончания изменяются в следующей последовательности: оватая (
 — хлорноватая кислота), истая (
— хлорноватая кислота), истая (
 — хлористая кислота), оватистая
— хлористая кислота), оватистая
 — хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисленности, то название кислоты, отвечающее низшей степени окисленности элемента, получает окончание истая (
— хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисленности, то название кислоты, отвечающее низшей степени окисленности элемента, получает окончание истая (
 - азотная кислота,
- азотная кислота,
 - азотистая кислота).
- азотистая кислота).
Одному и тому же кислотному оксиду (например,
 ) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например,
) могут соответствовать несколько кислот, содержащих по одному атому данного элемента в молекуле (например,
 ). В подобных случаях к названню кислоты, содержащей наименьшее число атомов кислорода, добавляется приставка мета, а к названию кислоты, содержащей наибольшее число атомов кислорода — приставка орто
). В подобных случаях к названню кислоты, содержащей наименьшее число атомов кислорода, добавляется приставка мета, а к названию кислоты, содержащей наибольшее число атомов кислорода — приставка орто
 — метафосфорная кислота,
— метафосфорная кислота,
 — ортофосфорная кислота). Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, то название кислоты снабжается соответствующей русской числительной приставкой; например,
— ортофосфорная кислота). Если же молекула кислоты содержит несколько атомов кислотообразующего элемента, то название кислоты снабжается соответствующей русской числительной приставкой; например,
 — двуфосфорная кислота,
— двуфосфорная кислота,
 четырехборная кислота.
четырехборная кислота.
Некоторые кислоты содержат в своем составе группировку атомов
 . Такие кислоты рассматриваются как производные пероксида водорода и называются пероксокислотами (старое название — надкислоты). Названия подобных кислот снабжаются приставкой пероксо и, если необходимо, русской числительной приставкой, указывающей число атомов кислотообразующего элемента в молекуле кислоты; например,
. Такие кислоты рассматриваются как производные пероксида водорода и называются пероксокислотами (старое название — надкислоты). Названия подобных кислот снабжаются приставкой пероксо и, если необходимо, русской числительной приставкой, указывающей число атомов кислотообразующего элемента в молекуле кислоты; например,
 — пероксосерная кислота,
— пероксосерная кислота,
 пероксодвусерпая кислота.
пероксодвусерпая кислота.
Основаниями с позиций теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. основные гидроксиды.
Наиболее характерное химическое свойство оснований — их способность взаимодействовать с кислотами (а также с кислотными и амфотерными оксидами) с образованием солей, например:
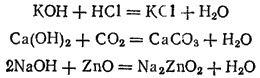
С позиций протонной теории кислот и оснований (§ 87) к основаниям относятся вещества, способные присоединять ионы водорода, т. е. быть акцепторами протонов. С этой точки зрения к основаниям относится, например, аммиак, который, присоединяя протон, образует аммоний-ион
 . Подобно основным гидроксидам аммиак взаимодействует с кислотами, образуя соли, например:
. Подобно основным гидроксидам аммиак взаимодействует с кислотами, образуя соли, например:
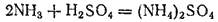
В зависимости от числа протонов, которые может присоединить основание, различают однокислотные основания
 , КОН,
, КОН,
 и т. д., двукислотные
и т. д., двукислотные
 и т. д. По силе основания делятся на сильные и слабые (§ 84); к сильным основаниям относятся все щелочи.
и т. д. По силе основания делятся на сильные и слабые (§ 84); к сильным основаниям относятся все щелочи.
К солям относятся вещества, диссоциирующие в растворах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид-ионов. Соли можно рассматривать как продукты замещения атомов водорода в кислоте атомами металлов (или группами атомов, например, группой атомов
 ) или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками. При полном замещении получаются средние (или нормальные) соли. При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания—основные соли. Ясно, что кислые соли могут быть образованы только кислотами, основность которых равна двум или больше, а основные соли — гидроксидами, содержащими не менее двух гидроксогрупп.
) или как продукты замещения гидроксогрупп в основном гидроксиде кислотными остатками. При полном замещении получаются средние (или нормальные) соли. При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания—основные соли. Ясно, что кислые соли могут быть образованы только кислотами, основность которых равна двум или больше, а основные соли — гидроксидами, содержащими не менее двух гидроксогрупп.
Примеры образования солей:
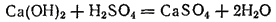
 (сульфат кальция)-нормальная соль;
(сульфат кальция)-нормальная соль;
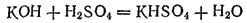
 (гидросульфат калия) — кислая соль;
(гидросульфат калия) — кислая соль;
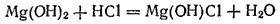
 (хлорид гидроксомагния)-основная соль.
(хлорид гидроксомагния)-основная соль.
Соли, образованные двумя металлами и одной кислотой, называются двойными солями; соли, образованные одним металлом и двумя кислотами, — смешанными солями. Примером двойной соли может служить сульфат калия-алюминия (алюмокалиевые квасцы)
 . К смешанным солям относится, например, хлорид-гипохлорит кальция
. К смешанным солям относится, например, хлорид-гипохлорит кальция
 — кальциевая соль соляной
— кальциевая соль соляной
 и хлорноватистой
и хлорноватистой
 кислот.
кислот.
Согласно современным номенклатурным правилам, названия солей образуются из названия аниона в именительном падеже и названия катиона в родительном падеже. Название аниона состоит из корня латинского наименования кислотообразующего элемента, окончания и, если необходимо, приставки (см. ниже).
Для названия катиона используемся русское наименование соответствующего металла или группы атомов; при этом, если необходимо, указывают (в скобках римскими цифрами) степень окисленности металла.
Анионы бескислородных кислот называются по общему для бинарных соединений правилу, т. е. получают окончание ид. Так,
 - фторид аммония,
- фторид аммония,
 — сульфид олова (II),
— сульфид олова (II),
 — цианид натрия. Окончания названий кислородсодержащих кислот зависят от степени окисленности кислотообразующего элемента. Для высшей его степени окисленности
— цианид натрия. Окончания названий кислородсодержащих кислот зависят от степени окисленности кислотообразующего элемента. Для высшей его степени окисленности
 или
или
 кислота) применяется окончание
кислота) применяется окончание
 например, соли азотной кислоты
например, соли азотной кислоты
 называются нитратами, серной кислоты
называются нитратами, серной кислоты
 — сульфатами, хромовой кислоты
— сульфатами, хромовой кислоты
 — хроматами. Для более низкой степени окисленности (
— хроматами. Для более низкой степени окисленности (
 кислота) применяется окончание ит; так, соли азотной кислоты
кислота) применяется окончание ит; так, соли азотной кислоты
 называются нитритами, сернистой кислоты
называются нитритами, сернистой кислоты
 — сульфитами. Если элемент образует кислоту, находясь в еще более низкой степени окисленности (
— сульфитами. Если элемент образует кислоту, находясь в еще более низкой степени окисленности (
 кислота), то название аниона этой кислоты получает приставку гипо и окончание
кислота), то название аниона этой кислоты получает приставку гипо и окончание
 например, соли хлорноватистой кислоты
например, соли хлорноватистой кислоты
 называются гипохлоритами.
называются гипохлоритами.
К названиям анионов кислот, содержащих несколько атомов кислотообразующего элемента, добавляются греческие числительные приставки, указывающие число этих атомов. Так, соли двусерной кислоты
 называются дисульфатами, четырехборной кислоты
называются дисульфатами, четырехборной кислоты
 тетраборатами.
тетраборатами.
Названия анионов пероксокислот Образуют с помощью приставки пероксо-, соли пероксосерной кислоты
 — пероксосульфаты, соли пероксодвусерной кислоты
— пероксосульфаты, соли пероксодвусерной кислоты
 — пероксодисульфаты — и т. д.
— пероксодисульфаты — и т. д.
Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро, указывающей на наличие незамещенных атомов водорода; если таких атомов два или больше, то их число указывают греческими числительными приставками. Так,
 — гидроортофосфат натрия,
— гидроортофосфат натрия,
 — дигидроортофосфат натрия. Аналогично катион основной соли получает приставку гидроксо, указывающую на наличие незамещенных гидроксогрупп. Например,
— дигидроортофосфат натрия. Аналогично катион основной соли получает приставку гидроксо, указывающую на наличие незамещенных гидроксогрупп. Например,
 — хлорид гидроксоалюминия,
— хлорид гидроксоалюминия,
 — хлорид дигидроксоалюминия.
— хлорид дигидроксоалюминия.
По исторически сложившейся традиции для солей хлорной
 , йодной
, йодной
 и марганцовой
и марганцовой
 кислот применяют названия, отличающиеся от систематических: их называют соответственно перхлоратами, периодатами и пермаганатами. Поэтому отличаются от систематических и общеупотребительные названия солей хлорноватой
кислот применяют названия, отличающиеся от систематических: их называют соответственно перхлоратами, периодатами и пермаганатами. Поэтому отличаются от систематических и общеупотребительные названия солей хлорноватой
 , йодноватой
, йодноватой
 и марганцовистой
и марганцовистой
 кислот (соответственно — хлораты, иодаты и манганаты).
кислот (соответственно — хлораты, иодаты и манганаты).
Ниже приведены названия солей важнейших кислот:

| << Предыдущий параграф | Следующий параграф >> |
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
