213. Стронций (Strontium). Барий (Barium).
Стронций и барий встречаются в природе главным образом в виде сульфатов и карбонатов, образуя минералы целестин , стронцианит
, стронцианит
 , барит
, барит
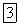 и витерит
и витерит
 . Содержание стронция и бария в земной коре соответственно равно 0,04 и
. Содержание стронция и бария в земной коре соответственно равно 0,04 и
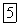 , т. е. значительно меньше, чем содержание кальция.
, т. е. значительно меньше, чем содержание кальция.
Металлические стронций и барий очень активны, быстро окисляются на воздухе, довольно энергично взаимодействуют с водой (особенно барий) и непосредственно соединяются со многими элементами.
Оксиды стронция и бария
 и
и
 сходны с оксидом кальция. Оба металла образуют также пероксиды. Пероксид бария
сходны с оксидом кальция. Оба металла образуют также пероксиды. Пероксид бария
 получается при нагревании оксида бария на воздухе примерно до
получается при нагревании оксида бария на воздухе примерно до
 . При высокой температуре она снова разлагается на оксид и кислород. Пероксид бария, как и пероксид натрия, используют для беления различных материалов.
. При высокой температуре она снова разлагается на оксид и кислород. Пероксид бария, как и пероксид натрия, используют для беления различных материалов.
Гидроксиды стронция и бария
 и
и
 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при
представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при
 растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Соли стронция и бария имеют сходство с солями кальция. Карбонаты и сульфаты
 и
и
 обладают очень малой растворимостью в воде и выпадают из раствора в виде осадков, если ионы стронция и бария встречаются с ионами
обладают очень малой растворимостью в воде и выпадают из раствора в виде осадков, если ионы стронция и бария встречаются с ионами
 . Этим пользуются при анализе для отделения стронция и бария от других металлов.
. Этим пользуются при анализе для отделения стронция и бария от других металлов.
Характерным отличием всех трех металлов друг от друга может служить окраска, сообщаемая их летучими солями несветящему пламени. Соли кальция окрашивают пламя в кирпично-красный цвет, соли стронция — в карминовокрасный, а соли бария — в желтовато-зеленый.
ПОБОЧНАЯ ПОДГРУППА ВТОРОЙ ГРУППЫ
Элементы этой подгруппы — цинк, кадмий и ртуть — характеризуются наличием двух электронов в наружном слое атома и восемнадцати в предыдущем. Строение двух наружных электронных оболочек их атомов можно отразить формулой
 .
.
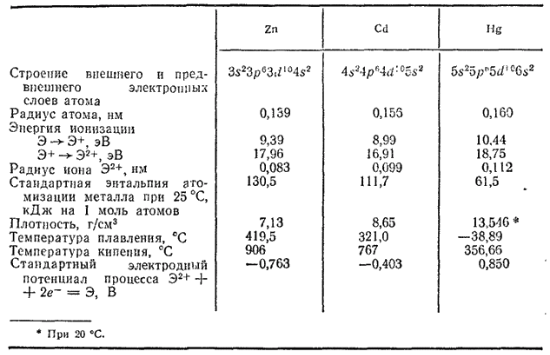
В табл. 34 приведены некоторые свойства этих металлов.
Восстановительные свойства элементов подгруппы цинка выражены значительно слабее, чем у элементов главной подгруппы. Это объясняется меньшими размерами атомов и, соответственно, более высокими энергиями ионизации этих элементов по сравнению с соответствующими элементами главной подгруппы
 . данные табл. 33 и 34).
. данные табл. 33 и 34).
Таблица 34. Некоторые свойства элементов побочной подгруппы второй группы
У атомов цинка, кадмия и ртути, как и у атомов элементов подгруппы меди,
 -подуровень второго снаружи электронного слоя целиком заполнен. Однако у элементов подгруппы цинка этот подуровень уже вполне стабилен и удаление из него электронов требует очень большой затраты энергии. Поэтому рассматриваемые элементы проявляют в своих соединениях степень окисленности
-подуровень второго снаружи электронного слоя целиком заполнен. Однако у элементов подгруппы цинка этот подуровень уже вполне стабилен и удаление из него электронов требует очень большой затраты энергии. Поэтому рассматриваемые элементы проявляют в своих соединениях степень окисленности
 . Ртуть, кроме того, образует соединения, в которых ее степень окисленности равна
. Ртуть, кроме того, образует соединения, в которых ее степень окисленности равна
 но, как будет показано ниже (см. § 216), и в этих соединениях ртуть следует считать двухвалентной.
но, как будет показано ниже (см. § 216), и в этих соединениях ртуть следует считать двухвалентной.
Характерной особенностью элементов подгруппы цинка, сближающей их с элементами подгруппы меди, является их склонность к комплексообразованию.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
