147. Оксиды и кислоты фосфора.
К важнейшим оксидам фосфора принадлежат и
и
 .
.
Оксид
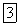 , или фосфористый ангидрид,
, или фосфористый ангидрид,
 получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при
получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при
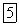 . Молекулярная масса его при низких температурах соответствует формуле
. Молекулярная масса его при низких температурах соответствует формуле
 . При действии холодной воды оксид
. При действии холодной воды оксид
 медленно взаимодействует с ней, образуя фосфористую кислоту
медленно взаимодействует с ней, образуя фосфористую кислоту
 . Как оксид
. Как оксид
 , так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
, так и фосфористая кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора (V), или фосфорный ангидрид,
 образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы. Плотность его пара соответствует формуле
образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы. Плотность его пара соответствует формуле
 .
.
Оксид фосфора (V) жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. На воздухе оксид
 , притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
, притягивая влагу, быстро превращается в расплывающуюся массу метафосфорной кислоты.
Фосфорные кислоты. Оксиду
 отвечает несколько кислот. Важнейшая из них — это ортофосфорная кислота
отвечает несколько кислот. Важнейшая из них — это ортофосфорная кислота
 , называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии
, называемая обычно просто фосфорной. Другие фосфорные кислоты представляют собою полимерные соединения. В анионе всех фосфорных кислот атом фосфора, находящийся в состоянии
 -гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры
-гибридизации, окружен четырьмя атомами кислорода, расположенными в вершинах тетраэдра. Ортофосфорная кислота построена из изолированных тетраэдров, в других фосфорных кислотах тетраэдры
 объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка
объединены через атомы кислорода в агрегаты, содержащие от двух до весьма большого числа — порядка
 атомов фосфора.
атомов фосфора.
Ортофосфорная кислота
 образует бесцветные прозрачные кристаллы, плавящиеся при
образует бесцветные прозрачные кристаллы, плавящиеся при
 . В воде она растворяется очень хорошо.
. В воде она растворяется очень хорошо.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Константы ее диссоциации равны:
 . Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами:
. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке. Средние соли фосфорной кислоты называют ортофосфатами или просто фосфатами, кислые — гидрофосфатами:

Дигидрофосфаты растворимы в воде; из гидрофосфатов и средних фосфатов хорошо растворимы лишь соли щелочных металлов и аммония.
В водных растворах фосфаты гидролизуются. При этом растворы средних солей щелочных металлов имеют сильно щелочную реакцию. Например,
 раствора
раствора
 равен 12,1. В случае кислых солей гидролиз сопровождается диссоциацией кислотного остатка (см. § 92). Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидрофосфатов этих
равен 12,1. В случае кислых солей гидролиз сопровождается диссоциацией кислотного остатка (см. § 92). Поэтому растворы гидрофосфатов щелочных металлов имеют слабо щелочную реакцию, а растворы дигидрофосфатов этих
 — слабокислую. Например,
— слабокислую. Например,
 раствора
раствора
 равен
равен
 .
.
В лаборатории фосфорную кислоту можно получать окислением фосфора
 -ной
-ной
 . Реакция протекает согласно уравнению;
. Реакция протекает согласно уравнению;
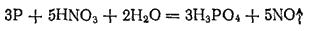
В промышленности фосфорную кислоту получают двумя методами; экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:
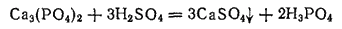
Образующуюся фосфорную кислоту отфильтровывают от сульфата кальция и концентрируют выпариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием и растворением образующегося фосфорного ангидрида в воде. Получаемая по этому методу термическая фосфорная кислота отличается более высокой чистотой и повышенной концентрацией.
Помимо производства удобрений (см. § 148), фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для создания защитных покрытий на металлах. Фосфаты кальция и аммония применяются при производстве эмалей, в фармацевтической промышленности.
Все другие фосфорные кислоты представляют собой продукты соединения тетраэдров
 . В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей. В зависимости от способа соединения групп
. В большинстве своем эти кислоты не выделены в свободном состоянии, а известны в виде смесей, в водных растворах или в виде солей. В зависимости от способа соединения групп
 в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифосфорные кислоты и их соли — по
в фосфатные комплексы эти кислоты разделяются на полифосфорные и метафосфорные кислоты. Полифосфорные кислоты и их соли — по
 и фосфаты — построены из цепочек
и фосфаты — построены из цепочек
 . В метафосфорных кислотах и их солях - метафосфатах — тетраэдры
. В метафосфорных кислотах и их солях - метафосфатах — тетраэдры
 образуют кольца.
образуют кольца.
Из полифосфорных кислот в кристаллическом состоянии выделена только простейшая двуфосфорная (или пирофосфорная) кислота
 , образующая бесцветные кристаллы, плавящиеся при
, образующая бесцветные кристаллы, плавящиеся при
 . Ион
. Ион
 построен из двух тетраэдров
построен из двух тетраэдров
 с общим атомом кислорода.
с общим атомом кислорода.
Структурная формула двуфосфорной кислоты:
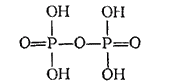
Двуфосфорная кислота хорошо растворяется в воде и является несколько более сильной кислотой, чем
 . Ее соли называются дифосфатами, или пирофосфатами.
. Ее соли называются дифосфатами, или пирофосфатами.
Метафосфорные кислоты имеют общую формулу
 , где n может принимать значения от 3 до 8; однако часто их состав выражают простейшей формулой
, где n может принимать значения от 3 до 8; однако часто их состав выражают простейшей формулой
 . Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфорные кислоты. Метафосфорные кислоты, ядовиты. Известны соли метафосфорных кислот — мета фосфаты. Некоторые из них выделены в виде кристаллов, например
. Эти кислоты представляют собою стеклообразные вещества. В раствор они переходят в виде полимеров, имеющих кольцевую структуру. С течением времени кольца расщепляются и образуются цепные полифосфорные кислоты. Метафосфорные кислоты, ядовиты. Известны соли метафосфорных кислот — мета фосфаты. Некоторые из них выделены в виде кристаллов, например
 . Метафосфаты применяются для умягчения воды и снижения ее коррозионной активности, для удаления накипи с паровых котлов, а также входят в состав некоторых моющих средств.
. Метафосфаты применяются для умягчения воды и снижения ее коррозионной активности, для удаления накипи с паровых котлов, а также входят в состав некоторых моющих средств.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
