201. Серебро (Argentum).
Серебро распространено в природе значительно меньше, чем медь; содержание его в земной коре составляет всего (масс). В некоторых местах (например, в Канаде) серебро встречается в самородном состоянии, но большую часть серебра получают из его соединений. Самой важной серебряной рудой является серебряный блеск, или аргентит,
(масс). В некоторых местах (например, в Канаде) серебро встречается в самородном состоянии, но большую часть серебра получают из его соединений. Самой важной серебряной рудой является серебряный блеск, или аргентит,
 .
.
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих
 и получают около
и получают около
 всего добываемого серебра.
всего добываемого серебра.
В СССР серебро получают главным образом из серебряно-свинцовых
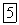 , месторождения которых имеются на Урале, Алтае, Северном Кавказе, в Казахстане.
, месторождения которых имеются на Урале, Алтае, Северном Кавказе, в Казахстане.
Чистое серебро — очень мягкий, тягучий металл, оно лучше всех металлов проводит теплоту и электрический ток.
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди.
Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды. Серебро используется для покрытия им других металлов, а также радиодеталей в целях повышения их электрической проводимости и устойчивости к коррозии. Часть добываемого серебра расходуется на изготовление серебряно-цинковых аккумуляторов.
В серебряно-цинковых аккумуляторах, обладающих хорошими электрическими характеристиками и имеющих малую массу и объем, электродами служат оксиды серебра
 (катод) и губчатый цинк (анод); электролитом служит раствор КОН.
(катод) и губчатый цинк (анод); электролитом служит раствор КОН.
При работе аккумулятора цинк окисляется, превращаясь в
 и
и
 , а оксид серебра восстанавливается до металла. Суммарную реакцию,
, а оксид серебра восстанавливается до металла. Суммарную реакцию,
 при разряде аккумулятора, можно приближенно выразить уравнением:
при разряде аккумулятора, можно приближенно выразить уравнением:
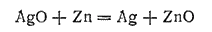
Э. д. с. заряженного серебряно-цинкового аккумулятора приближенно равна 1,85 В. При снижении напряжения до 1,25 В аккумулятор заряжают. При этом
 электродах «обращаются»: цинк восстанавливается, серебро окисляется — вновь получаются вещества, необходимые для работы аккумулятора.
электродах «обращаются»: цинк восстанавливается, серебро окисляется — вновь получаются вещества, необходимые для работы аккумулятора.
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов — результат образования на их поверхности черного сульфида серебра
 . Это происходит под влиянием содержащегося в воздухе сероводорода (см. стр. 371), а также при соприкосновении серебряных предметов с пищевыми продуктами, содержащими соединения серы.
. Это происходит под влиянием содержащегося в воздухе сероводорода (см. стр. 371), а также при соприкосновении серебряных предметов с пищевыми продуктами, содержащими соединения серы.
В ряду напряжений серебро расположено значительно дальше водорода. Поэтому соляная и разбавленная серная кислоты на него не действуют. Растворяют серебро обычно в азотной кислоте, которая взаимодействует с ним согласно уравнению:
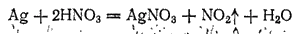
Серебро образует один ряд солей, растворы которых содержат бесцветные катионы
 .
.
Оксид
 , или закись серебра,
, или закись серебра,
 . При действии щелочей на растворы солей серебра можно ожидать получения
. При действии щелочей на растворы солей серебра можно ожидать получения
 , но вместо него выпадает бурый осадок оксида
, но вместо него выпадает бурый осадок оксида
 :
:
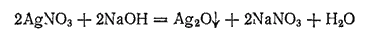
Оксид серебра (I) незначительно растворяется в воде
 , Получающийся раствор имеет щелочную реакцию и, подобий щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра
, Получающийся раствор имеет щелочную реакцию и, подобий щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра
 , представляющий собой довольно сильное основание.
, представляющий собой довольно сильное основание.
Последнее подтверждается тем, что соли серебра не гидролизуются.
Кроме оксида серебра (I) известны оксиды
 и
и
 .
.
Наибольшее значение имеют следующие соли серебра.
Нитрат серебра
 , называемый также ляписом. Образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике, в медицине.
, называемый также ляписом. Образует бесцветные прозрачные кристаллы, хорошо растворимые в воде. Применяется в производстве фотоматериалов, при изготовлении зеркал, в гальванотехнике, в медицине.
Хлорид серебра
 образуется в виде белого творожистого нерастворимого в воде и кислотах осадка при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра. Такими же свойствами обладают бромид и иодид серебра, имеющие в отличие от хлорида серебра желтоватый цвет. Напротив, фторид серебра
образуется в виде белого творожистого нерастворимого в воде и кислотах осадка при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра. Такими же свойствами обладают бромид и иодид серебра, имеющие в отличие от хлорида серебра желтоватый цвет. Напротив, фторид серебра
 растворим в воде.
растворим в воде.
Комплексные соединения серебра. Подобно меди, серебро обладает склонностью к образованию комплексных соединений.
Многие нерастворимые в воде соединения серебра, например оксид
 и хлорид серебра, легко растворяются в водном растворе аммиака. Причина растворения заключается в образовании комплексных ионов
и хлорид серебра, легко растворяются в водном растворе аммиака. Причина растворения заключается в образовании комплексных ионов
 . Например, равновесия, устанавливающиеся при взаимодействии хлорида серебра с водным раствором аммиака, можно представить следующей схемой:
. Например, равновесия, устанавливающиеся при взаимодействии хлорида серебра с водным раствором аммиака, можно представить следующей схемой:
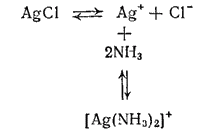
В насыщенном растворе хлорида серебра устанавливается динамическое равновесие между ионами
 и
и
 и осадком
и осадком
 . Вводимые в раствор молекулы аммиака связываются с ионами серебра в комплексные ионы
. Вводимые в раствор молекулы аммиака связываются с ионами серебра в комплексные ионы
 и осадок растворяется. Таким образом, в аммиачном растворе серебро находится в виде комплексных катионов
и осадок растворяется. Таким образом, в аммиачном растворе серебро находится в виде комплексных катионов
 . Но наряду с ними в растворе всегда остается и некоторое, хотя и незначительное количество ионов серебра вследствие диссоциации комплексного иона согласно уравнению:
. Но наряду с ними в растворе всегда остается и некоторое, хотя и незначительное количество ионов серебра вследствие диссоциации комплексного иона согласно уравнению:
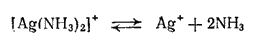
Комплексные цианистые соединения серебра применяются для гальванического серебрения, так как при электролизе растворов этих солей на поверхности изделий осаждается плотный слой мелкокристаллического серебра.
При пропускании тока через раствор
 серебро выделяется на катоде за счет незначительного количества ионов серебра, которое получается вследствие диссоциации комплексного аниона:
серебро выделяется на катоде за счет незначительного количества ионов серебра, которое получается вследствие диссоциации комплексного аниона:
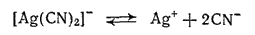
Все соединения серебра легко восстанавливаются с выделением металлического серебра. Если к аммиачному раствору оксида серебра (I), находящемуся в стеклянном сосуде, прибавить в качестве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах Дьюара и в термосах для уменьшения потери теплоты лучеиспусканием.
Соли серебра, особенно хлорид и бромид, ввиду их способности разлагаться под влиянием света с выделением металлического серебра, широко используются для изготовления фотоматериалов — пленки, бумаги, пластинок. Фотоматериалы обычно представляют собой светочувствительную суспензию
 в желатине, слой которой нанесен на целлулоид, бумагу
в желатине, слой которой нанесен на целлулоид, бумагу
 стекло.
стекло.
При экспозиции в тех местах светочувствительного слоя, где на него попал свет, образуются мельчайшие зародыши кристаллов металлического серебра. Это — скрытое изображение фотографируемого предмета. При проявлении бромид серебра разлагается, причем скорость разложения тем больше, чем выше концентрация зародышей в данном месте слоя. Получается видимое изображение, которое является обращенным, или негативны и, изображением, поскольку степень почернения в каждом месте светочувствительного слоя тем больше, чем выше была его освещенность при экспозиции. В ходе
 а -крепления (фиксирования) из светочувствительного слоя удаляется неразложившийся бромид серебра. Это происходит в результате взаимодействия между
а -крепления (фиксирования) из светочувствительного слоя удаляется неразложившийся бромид серебра. Это происходит в результате взаимодействия между
 и веществом закрепителя — тиосульфатом натрия. При этой реакции получается растворимая комплексная соль:
и веществом закрепителя — тиосульфатом натрия. При этой реакции получается растворимая комплексная соль:
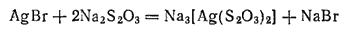
Далее негатив накладывают на фотобумагу и подвергают действию света — «печатают». При этом наиболее освещенными оказываются те места фотобумаги, которые находятся против светлых мест негатива. Поэтому в ходе печатания соотношение между светом и тенью меняется на обратное и становится отвечающим сфотографированному объекту. Это — позитивное изображение.
Ионы серебра подавляют развитие бактерий и уже в очень низкой концентрации (около
 моль/л) стерилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек применяются стабилизированные специальными добавками коллоидные растворы серебра (протаргол, колларгол и
моль/л) стерилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек применяются стабилизированные специальными добавками коллоидные растворы серебра (протаргол, колларгол и
 ).
).
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
-
ВВЕДЕНИЕ
-
Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
-
4. Закон сохранения массы.
-
5. Основное содержание атомно-молекулярного учения.
-
6. Простое вещество и химический элемент.
-
7. Закон постоянства состава.
-
8. Закон объемных отношений.
-
9. Атомные и молекулярные массы. Моль.
-
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
-
11. Парциальное давление газа.
-
12. Эквивалент. Закон эквивалентов.
-
13. Определение атомных масс. Валентность.
-
14. Химическая символика.
-
15. Важнейшие классы и номенклатура неорганических веществ.
-
16. Химические расчеты.
Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
-
17. Периодический закон Д. И. Менделеева.
-
18. Периодическая система элементов.
-
19. Значение периодической системы.
Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
-
20. Радиоктивность.
-
21. Ядерная модель атома.
-
22. Атомные спектры.
-
23. Квантовая теория света.
-
24. Строение электронной оболочки атома по Бору.
-
25. Исходные представления квантовой механики.
-
26. Волновая функция.
-
27. Энергетическое состояние электрона в атоме.
-
29. Орбитальное квантовое число. Формы электронных облаков.
-
30. Магнитное и спиновое квантовые числа.
-
31. Многоэлектронные атомы.
-
32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
-
33. Размеры атомов и ионов.
-
34. Энергия ионизации и сродство к электрону.
-
35. Строение атомных ядер. Изотопы.
-
36. Радиоактивные элементы и их распад.
-
37. Искусственная радиоктивность. Ядерные реакции.
-
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
-
38. Теория химического строения.
-
39. Ковалентная связь. Метод валентных связей.
-
40. Неполярная и полярная ковалентная связь.
-
41. Способы образования ковалентной связи.
-
42. Направленность ковалентной связи.
-
43. Гибридизация атомных электронных орбиталей.
-
44. Многоцентровые связи.
-
45. Метод молекулярных орбиталей.
-
46. Ионная связь.
-
47. Водородная связь.
Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
-
48. Межмолекулярное взаимодействие.
-
49. Кристаллическое состояние вещества.
-
50. Внутреннее строение кристаллов.
-
51. Реальные кристаллы.
-
52. Аморфное состояние вещества.
-
53. Жидкости.
Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
-
54. Превращения энергии при химических реакциях.
-
55. Термохимия.
-
56. Термохимические расчеты.
-
57. Скорость химической реакции.
-
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
-
60. Катализ.
-
61. Скорость реакции в гетерогенных системах.
-
62. Цепные реакции.
-
63. Необратимые и обратимые реакции. Химическое равновесие.
-
64. Смещение химического равновесия. Принцип Ле Шателье.
-
65. Факторы, определяющие направление протекания химических реакций.
-
66. Термодинамические величины. Внутренняя энергия и энтальпия.
-
67. Термодинамические величины. Энтропия и энергия Гиббса.
-
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Глава VII. ВОДА, РАСТВОРЫ
-
69. Вода в природе.
-
70. Физические свойства воды.
-
71. Диаграмма состояния воды.
-
72. Химические свойства воды.
-
73. Характеристика растворов. Процесс растворения.
-
74. Способы выражения состава растворов.
-
75. Гидраты и кристаллогидраты.
-
76. Растворимость.
-
77. Пересыщенные растворы.
-
78. Осмос.
-
79. Давление пара растворов.
-
80. Замерзание и кипение растворов.
Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
81. Особенности растворов солей, кислот и оснований.
-
82. Теория электролитической диссоциации.
-
83. Процесс диссоциации.
-
84. Степень диссоциации. Сила электролитов.
-
85. Константа диссоциации.
-
86. Сильные электролиты.
-
87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
-
88. Ионно-молекулярные уравнения.
-
89. Произведение растворимости.
-
90. Диссоциация воды. Водородный показатель.
-
91. Смещение ионных равновесий.
-
92. Гидролиз солей.
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
-
93. Окисленность элементов.
-
94. Окислительно-восстановительные реакции.
-
95. Составление уравнений окислительно-восстановительных реакций.
-
96. Важнейшие окислители и восстановители.
-
97. Окислительно-восстановительная двойственность.
-
98. Химические источники электрической энергии.
-
99. Электродные потенциалы.
-
100. Ряд напряжений металлов.
-
101. Электролиз.
-
102. Законы электролиза.
-
103. Электролиз в промышленности.
-
104. Электрохимическая поляризация.
Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
-
105. Дисперсное состояние вещества.
-
106. Состояние вещества на границе раздела фаз.
-
107. Коллоиды и коллоидные растворы.
-
108. Дисперсионный анализ.
-
109. Сорбция и сорбционные процессы.
-
110. Ионообменная адсорбция.
-
111. Хроматография.
-
112. Электрокинетические явления.
-
113. Устойчивость и коагуляция дисперсных систем.
-
114. Структурообразование в дисперсных системах.
Глава XI. ВОДОРОД
-
115. Водород в природе. Получение водорода.
-
116. Свойства и применение водорода.
-
117. Пероксид водорода
-
Глава XII. ГАЛОГЕНЫ
-
118. Галогены в природе. Физические свойства галогенов.
-
119. Химические свойства галогенов.
-
120. Получение и применение галогенов.
-
121. Соединения галогенов с водородом.
-
122. Кислородсодержащие соединения галогенов.
-
Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
-
123. Кислород в природе. Воздух.
-
124. Получение и свойства кислорода.
-
125. Озон.
-
126. Сера в природе. Получение серы.
-
127. Свойства и применение серы.
-
128. Сероводород. Сульфиды.
-
129. Диоксид серы. Сернистая кислота.
-
130. Триоксид серы. Серная кислота.
-
131. Получение и применение серной кислоты.
-
132. Пероксодвусерная кислота.
-
133. Тиосерная кислота.
-
134. Соединения серы с галогенами.
-
135. Селен (Selenium). Теллур (Tellurium).
-
Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
-
136. Азот в природе. Получение и свойства азота.
-
137. Аммиак. Соли аммония.
-
138. Фиксация атмосферного азота. Получение аммиака.
-
139. Гидразин. Гидроксиламин. Азидоводород.
-
140. Оксиды азота.
-
141. Азотистая кислота.
-
142. Азотная кислота.
-
143. Промышленное получение азотной кислоты.
-
144. Круговорот азота в природе.
-
145. Фосфор в природе. Получение и свойства фосфора.
-
146. Соединения фосфора с водородом и галогенами.
-
147. Оксиды и кислоты фосфора.
-
148. Минеральные удобрения.
-
149. Мышьяк (Arsenicum).
-
150. Сурьма (Stibium).
-
151. Висмут (Bismuthum).
-
Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
-
152. Углерод в природе.
-
153. Аллотропия углерода.
-
154. Химические свойства углерода. Карбиды.
-
155. Диоксид углерода. Угольная кислота.
-
156. Оксид углерода (II).
-
157. Соединения углерода с серой и азотом.
-
158. Топливо и его виды.
-
159. Газообразное топливо.
-
160. Общая характеристика органических соединений.
-
161. Отличительные особенности органических соединений.
-
162. Теория химического строения органических соединений.
-
163. Классификация органических соединений.
-
164. Предельные (насыщенные) углеводороды.
-
165. Непредельные (ненасыщенные) углеводороды.
-
166. Предельные циклические углеводороды.
-
167. Ароматические углеводороды.
-
168. Галогенпроизводные углеводородов.
-
169. Спирты и фенолы.
-
170. Простые эфиры.
-
171. Альдегиды и кетоны.
-
172. Карбоновые кислоты.
-
173. Сложные эфиры карбоновых кислот. Жиры.
-
174. Углеводы.
-
175. Амины.
-
176. Аминокислоты и белки.
-
177. Природные и синтетические высокомолекулярные соединения (полимеры).
-
178. Кремний в природе. Получение и свойства кремния.
-
179. Соединения кремния с водородом и галогенами.
-
180. Диоксид кремния.
-
181. Кремниевые кислоты и их соли.
-
182. Стекло.
-
183. Керамика.
-
184. Цемент.
-
185. Кремнийорганические соединения.
-
186. Германий (Germanium).
-
187. Олово (Stannuin).
-
188. Свинец (Plumbum).
-
189. Свинцовый аккумулятор.
Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
-
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
-
191. Кристаллическое строение металлов.
-
192. Добывание металлов из руд.
-
193. Получение металлов высокой чистоты.
-
194. Сплавы.
-
195. Диаграммы состояния металлических систем.
-
196. Коррозия металлов.
-
Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
197. Щелочные металлы в природе.
-
198. Натрий (Natrium).
-
199. Калий (Kalium).
-
ПОДГРУППА МЕДИ
-
200. Медь. (Cuprum).
-
201. Серебро (Argentum).
-
202. Золото (Aurum).
-
Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
-
203. Основные положения координационной теории.
-
204. Основные типы и номенклатура комплексных соединений.
-
205. Пространственное строение и изомерия комплексных соединений.
-
206. Природа химической связи в комплексных соединениях.
-
207. Диссоциация комплексных соединений в растворах.
-
208. Влияние координации на свойства лигандов и центрального атома.
-
Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
209. Бериллий (Beryllium).
-
210. Магний (Magnesium).
-
211. Кальций (Calcium).
-
212. Жесткость природных вод и ее устранение.
-
213. Стронций (Strontium). Барий (Barium).
-
214. Цинк (Zincum).
-
215. Кадмий (Cadmium).
-
216. Ртуть (Hydrargyrum).
-
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
217. Бор (Borum).
-
218. Алюминий (Aluminium).
-
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
-
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
-
220. Подгруппа скандия.
-
221. Лантаноиды.
-
222. Актиноиды.
-
Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
ПОДГРУППА ТИТАНА
-
224. Титан (Titanium).
-
225. Цирконий (Zirconium). Гафний (Hafnium).
ПОДГРУППА ВАНАДИЯ
-
226. Ванадий (Vanadium).
-
227. Ниобий (Niobium). Тантал (Tantalum).
ПОДГРУППА ХРОМА
-
228. Хром (Chromium).
-
229. Молибден (Mollbdenium).
-
230. Вольфрам (Wolfram).
ПОДГРУППА МАРГАНЦА
-
231. Марганец (Manganum).
-
232. Рений (Rhenium).
Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
-
233. Общая характеристика благородных газов.
-
234. Гелий (Helium).
-
235. Неон. Аргон.
-
ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
-
236. Железо (Ferrum).
-
237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
-
238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
-
239. Производство чугуна и стали.
-
240. Термическая обработка стали.
-
241. Сплавы железа.
-
242. Химические свойства железа. Соединения железа.
-
243. Кобальт (Cobaltum).
-
244. Никель (Niccolum).
-
245. Общая характеристика платиновых металлов.
-
246. Платина (Platinum).
-
247. Палладий (Palladium). Иридий (Iridium).
ПРИЛОЖЕНИЕ
-
Некоторые единицы СИ
-
Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
-
Соотношения между некоторыми внесистемными единицами и единицами СИ
-
Литература для углубленного изучения общей и неорганической химии
